康诺亚新药获批上市,为特应性皮炎患者点亮新希望之光
2024-10-30 互联网近日,康诺亚倾力自主研发的IL-4Rα抗体新药——司普奇拜单抗,已顺利取得国家药品监督管理局的上市许可。此举不仅意味着司普奇拜单抗正式步入临床实践的舞台,还预示着它将引领中重度特应性皮炎治疗进入EASI-90(湿疹面积和严重程度指数程度改善90%及以上)达标的新篇章,同时也为中重度特应性皮炎患者点亮了治疗的新希望。
康诺亚:新药成功上市,自主研发能力再获有力证明
康诺亚是一家专注创新药物自主研发和生产的综合性生物制药公司,多年来坚持自主创新,以高效集成的内部研发实力,依托新型T细胞重定向(nTCE)双特异性平台、抗体偶联药物平台、小核酸药物平台等专有平台,打造行业领先的药物发现引擎,不断致力于为全球患者开发、生产更高质量、可负担的创新药物。此次新药司普奇拜单抗的成功研制与上市,再次证明了康诺亚在自主研发领域的超强能力。
中重度特应性皮炎治疗药物再添“新成员”,疗效与安全性均令人满意
既往临床中,中重度特应性皮炎治疗常选用生物制剂度普利尤单抗,而国产生物制剂司普奇拜单抗成功上市,为特应性皮炎患者开辟新选择。那么司普奇拜单抗的治疗效果究竟如何?看看近期公布的长达52周的III期临床研究数据。
司普奇拜单抗:首剂起效,1天快速缓解瘙痒
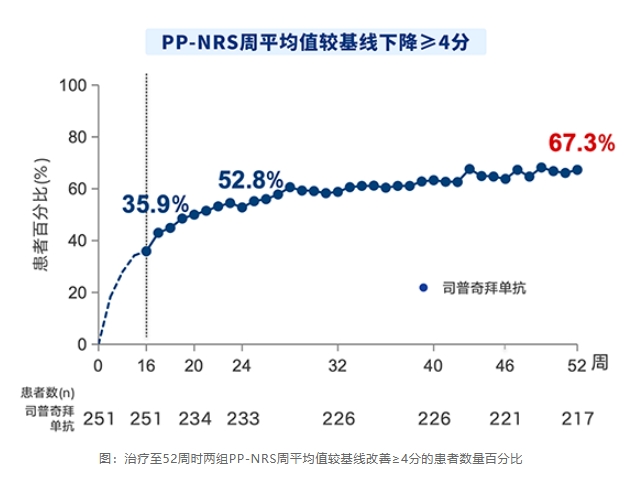
该III期临床研究结果表明,司普奇拜单抗治疗第1天,可显著缓解瘙痒症状。在第16周时,司普奇拜单抗治疗组缓解瘙痒的效果同样显著优于安慰剂组(35.9% vs 11.7%,P<0.0001)。由此可以看出,司普奇拜单抗可在一天快速缓解瘙痒,持续治疗16周后的控痒水平也很优秀。
司普奇拜单抗:长期治疗,超过90%患者可实现75%以上的皮损改善
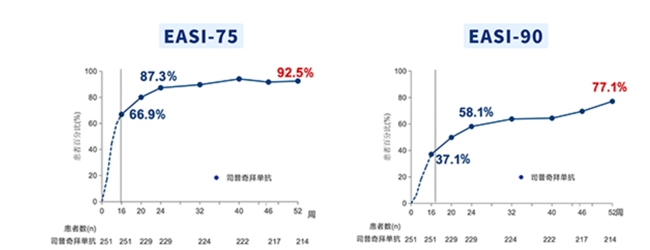
司普奇拜单抗维持治疗期间,EASI-75/90(使用药物后原有湿疹面积和严重程度改善了75%/90%)应答率都呈持续上升水平。当司普奇拜单抗治疗时间持续至52周时,EASI-75应答率高达92.5%,EASI-90应答率也高达77.1%,这证明司普奇拜单抗可持续改善皮损,并标志着特应性皮炎治疗EASI-90时代已开启。值得一提的是,在从安慰剂转换到司普奇拜单抗的患者中,特应性皮炎的症状仍然可以迅速且显著地得到改善。
长期安全性耐受性良好,安心守护患者健康
关于新药的安全性,对应的研究数据也给出了让人放心的答案。该研究结果表明,司普奇拜单抗治疗52周,未发现新的安全性信号。整体来说,安全性与耐受性结果均良好。
总的来说,从III期临床研究数据和上市后患者的积极反馈来看,不论是疗效还是安全性司普奇拜单抗都表现优异。这款新药的成功上市,不仅为中重度特应性皮炎患者带来了新的希望,也彰显了康诺亚在创新药物研发领域的深厚实力与卓越贡献。未来,康诺亚将继续秉承自主创新理念,依托前沿技术平台,加速推进更多优质药物的研发与上市,为全球患者提供更多更好的生物治疗新选择。